知的財産高等裁判所第2部(清水響裁判長)は、本年(令和7年・2025年)5月27日、存続期間の延長登録がされた医薬用途発明に係る特許権に基づく損害賠償請求を一部認容する判決を下しました。本判決は、特許発明の技術的範囲における有効成分の意義、延長登録された医薬用途発明に係る特許権の効力が及ぶ範囲、及び延長登録の延長期間等について判示するものです。なお、本判決に対しては、被告両名から上告および上告受理の申立てがなされています。
ポイント
本判決の骨子
本件発明の技術的範囲と被告製剤について
- 本件特許の請求項1に記載の発明(以下、「本件発明」という)は、一般式(Ⅰ)で示されるオピオイドκ受容体作動性化合物(以下、「本件化合物」という)を有効成分とする止痒剤であり、止痒作用が極めて速くて強い止痒剤を提供することを目的とする。
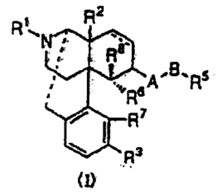
- 製剤の技術分野において、本件特許の出願当時、薬物の溶解性や安定性を向上させるために酸付加塩の形態をとることは、技術常識であったから、当業者は、本件発明の目的である止痒作用を発揮する化学物質は「κ受容体作動性化合物」であって、「薬理学的に許容される酸付加塩」の形態は、物質の止痒作用自体を変化させるためのものではなく、薬としての溶解性や安定性を向上させるための形態にすぎないことは容易に理解することができた。
- 特許請求の範囲、明細書の記載、出願経過及び技術常識によれば、本件発明は、酸付加塩の形態をとるか否かにかかわらず、本件化合物が、生体内において溶出して吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解釈するべきである。
- 被告製剤は、本件化合物を充足するナルフラフィンの塩酸塩を含むものであり、当該塩酸塩は生体内において溶出して吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するため、本件発明の構成要件を満たし、その技術的範囲に属する。
存続期間が延長された本件特許権の効力について
- 特許法第68条の2の解釈として、薬機法に基づく処分で特定された「物」から出発し、特許発明の技術的意義及び当該処分の内容に照らし、これと医薬品として「実質同一」であると認められる範囲の物についての実施に限り、延長後の特許権の効力が及ぶと解するのが相当である。そうすると、同条の「物」(対象物)には原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から実質同一であると認められるものも含まれるというべきである。
- 本件発明は、本件化合物のκ受容体作動性という未知の属性に基づき、新たな止痒剤としての医薬用途を提供する医薬用途発明である点に、発明としての技術的特徴があり、止痒剤に含有される添加剤については何ら特定されていない。原告製剤と被告製剤は「有効成分、分量」及び「用法、用量、効能、効果」は同じであり、両製剤の差異は、有効成分を除く添加剤の限度で成分を異にするという形式的なものにすぎない。
- よって、被告製剤は、医薬品として本件処分等の対象となった原告製剤と実質同一であるといえ、延長された本件特許権の効力が及ぶ。
延長登録の延長期間について
- 本件処分(後行処分)に係る剤形をOD錠とする製剤の承認申請の審査において、剤形を軟カプセル剤とする製剤に対する先行処分においてなされた臨床試験結果が用いられており、先行処分のために必要な臨床試験期間も、後行処分のための必要な期間として算入できる。
- 医薬品における「前記政令で定める処分を受けるために特許発明を実施することができなかった期間」は、薬機法に基づく当該医薬品の承認手続の内容、承認による禁止解除の範囲についての解釈を踏まえ、特許法の観点から個別に判断されるものである。
- 軟カプセル剤の承認による禁止解除の範囲は剤形を軟カプセル剤とする場合に限定され、直ちにはOD錠には及ばないのであり、原告において、同じ有効成分・分量、用法・用量及び効能・効果であっても、軟カプセル剤の承認を受けただけで、本件処分等を受けることなくOD錠の剤形で本件特許を実施することができるわけではないため、軟カプセル剤とOD錠につき二重に臨床試験期間を回復することにはならない。
判決概要
| 裁判所 | 知的財産高等裁判所第2部 |
|---|---|
| 判決言渡日 | 令和7年5月27日 |
| 事件番号 事件名 |
令和3年(ネ)第10037号 特許権侵害差止等請求控訴事件 |
| 原判決 | 東京地方裁判所平成30年(ワ)第38504号〔A事件〕、同第38508号〔B事件〕 |
| 裁判官 | 裁判長裁判官 清 水 響 裁判官 菊 池 絵 理 裁判官 頼 晋 一 |
解説
特許法における延長登録制度について
特許制度は、発明の公開と引き換えに、特許法第67条1項において、特許出願日から20年間の独占権を認めることで、産業の発展に寄与することを目的としています。
(存続期間)
第六十七条 特許権の存続期間は、特許出願の日から二十年をもつて終了する。
しかし、医薬品などの分野では、安全性確保のための政府の許認可に長期間を要するため、その間、特許権者は権利を十分に活用できないという問題があります。このような事情を踏まえ、特許法は、政令で定める処分によって特許発明の実施が制限されていた期間について、5年を上限に特許権の存続期間を延長できる制度を設けています(特許法第67条第4項)。
(存続期間)
第六十七条
(略)
四 第一項に規定する存続期間・・・は、その特許発明の実施について安全性の確保等を目的とする法律の規定による許可その他の処分であつて当該処分の目的、手続等からみて当該処分を的確に行うには相当の期間を要するものとして政令で定めるものを受けることが必要であるために、その特許発明の実施をすることができない期間があつたときは、五年を限度として、延長登録の出願により延長することができる。
このように延長登録制度は、特許権者が本来享受できたはずの実施期間を回復することを目的として設けられたものです。
延長された特許権の効力の及ぶ範囲について
特許法第68条の2
延長登録制度の目的によれば、処分を受けることによって禁止が解除された範囲と特許発明の範囲の重複している部分のみに延長された場合の特許権の効力が及ぶとすることが必要になります(工業所有権法(産業財産権法)逐条解説[第22版])。そこで、特許法は、存続期間が延長された後の特許権の効力を、処分の対象となった物を、処分において定められる特定の用途について実施する場合にのみ及ぶことを規定しています。
(第六十七条第四項の規定により存続期間が延長された場合の特許権の効力)
第六十八条の二
第六十七条第四項の規定により同条第一項に規定する存続期間が延長された場合・・・の当該特許権の効力は、その延長登録の理由となつた第六十七条第四項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない。
延長された特許権の効力の及ぶ範囲の解釈
存続期間の延長を受けた特許権の効力が被告製剤に及ぶかを判断するにあたっては、2段階のステップを踏むことになります。1段階目のステップとして、被告製剤が特許発明の技術的範囲に属するかを判断します。被告製剤が特許発明の技術的範囲に属すると判断された場合には、2段階目のステップとして、特許法第68条の2に基づき、延長された特許権の効力が被告製剤に及ぶかを判断します。上述のとおり、特許法第68条の2は、存続期間の延長を受けた特許権の効力が及ぶ範囲を「政令で定める処分の対象となつた物」に限定しており、さらに当該物の用途が定められている場合は、当該用途に使用されるその物にまで限定されます。同条における「物」および「用途」の意義に関し、いわゆる「アバスチン事件」(知財高判大合議平成26年5月30日平成25年(行ケ)第10195,10196,10197,10198号)において知財高裁は、傍論ながら、延長された特許権の効力の及ぶ範囲について、特許法68条の2における「物」を有効成分、「用途」を「効能・効果」及び「用法・用量」と解しました。その後、いわゆる「オキサリプラチン事件」(知財高判大合議平成29年1月20日平成28年(ネ)第10046号)において、知財高裁は、延長された特許権の効力は、政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」(医薬品)のみならず,これと医薬品として実質同一なものにも及ぶとの判断を示しました(詳しくは、こちらの記事もご覧ください)。
延長登録の延長期間について
特許法には、医薬品等の特許権の存続期間の延長出願においては、その延長を求める期間がその特許発明の実施をすることができなかった期間を超えているときは、当該出願を拒絶すべき旨が規定されています(特許法第67条の7)。当該要件が課されているのは、延長登録制度の目的に基づき、延長を求める期間のうち、処分を受けることによって禁止された期間を超えている部分については、延長を認める理由がないことによります。
第六十七条の七 審査官は、第六十七条第四項の延長登録の出願が次の各号のいずれかに該当するときは、その出願について拒絶をすべき旨の査定をしなければならない。
(略)
三 その延長を求める期間がその特許発明の実施をすることができなかつた期間を超えているとき。
(略)
そして、「特許発明の実施をすることができなかつた期間」とは、「政令で定める処分を受けるのに必要な試験を開始した日又は特許権の設定登録の日のうちのいずれか遅い方の日から、承認又は登録が申請者に到達した日、すなわち申請者が現実にこれを了知し又は了知し得べき状態におかれた日の前日までの期間」をいうとされています(最二小判平成11年10月22日(平成10年(行ヒ)43号・民集53巻7号1270頁)、 最二小判平成11年10月22日(平成10年(行ヒ)44号)参照)。
事案の概要
事案
本事案は、特許第3531170号「止痒剤」の特許権者である原告が、本件特許権の存続期間が延長されたことを前提に、被告らが被告製剤を製造販売した行為は、延長された本件特許権を侵害するとして、被告らに対し損害賠償を請求したというものです。原審において裁判所は、被告ら製剤は本件発明の技術的範囲に属するということはできないと判断し、原告の請求を棄却する判決を下していました。
・本件特許について
本件発明の概要は以下のとおりです。
【請求項1】
下記一般式(I)
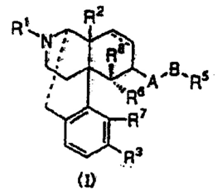
[式中、・・・(略)・・・]で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤。
本件特許は、下記表に示すとおり、合計4件の延長登録出願がなされ、いずれも延長登録がなされています。これらのうちの3件(下記表の①、③、④)については延長登録後に無効審決がなされましたが、いずれも審決取消訴訟が提起され、当該無効審決の取消判決がなされ確定しています(詳しくは、こちらの記事もご覧ください)。また残りの1件(下記表の②)については、一度拒絶審決がなされましたが、審決取消訴訟にて当該拒絶審決の取消判決がなされ確定しています。
| 延長登録出願 | 剤形 | 用途(そう痒症の対象患者) | 審決 | 取消訴訟(確定) | |
| ① | 特願2015-700061号 | カプセル | 慢性肝疾患患者 | 無効審決 | 無効取消 R2(行ケ)10096号 |
| ② | 特願2017-700154号 | OD錠 | 血液透析患者 慢性肝疾患患者 |
拒絶審決 | 拒絶取消 R2(行ケ)10063号 |
|---|---|---|---|---|---|
| ③ | 特願2017-700309号 | カプセル | 透析患者 (血液透析患者を除く) |
無効審決 | 無効取消 R2(行ケ)10097号 |
| ④ | 特願2017-700310号 | OD錠 | 透析患者 (血液透析患者を除く) |
無効審決 | 無効取消 R2(行ケ)10098号 |
本件は、剤形を「OD錠(口腔内崩壊錠)」、用途を「血液透析患者、慢性肝疾患患者に対するそう痒症」とする、上記②の延長登録がされた特許に基づく侵害訴訟になります。
・被告製剤について
被告らが製造販売していた被告製剤は、ナルフラフィンの酸付加塩であるナルフラフィン塩酸塩を含む止痒剤(OD錠)です。なお、ナルフラフィン(フリー体)は本件特許の特許請求の範囲で規定する本件化合物に該当するものの、被告ら製剤(原薬)に含まれるナルフラフィン塩酸塩は本件化合物に該当しません。
原審判決の骨子
原審において裁判所が判断した争点は、以下です。
| 原審争点1: | 被告ら製剤は一般式(Ⅰ)で示されるオピオイドκ受容体作動性化合物(以下、「本件化合物」という)であるナルフラフィン(フリー体)を「有効成分」とするものか |
| 原審争点2: | 被告ら製剤は本件発明に記載された構成と均等なものか |
このように原審において本件発明の技術的範囲の属否が争点となったのは、被告ら製剤は、本件化合物には該当しないナルフラフィン塩酸塩を原薬にしているものの、生体内においては、ナルフラフィン(フリー体)として溶出・吸収されるため、被告ら製剤は、本件化合物に該当するナルフラフィン(フリー体)を「有効成分」とするのではないか、という問題意識に基づきます。かかる問題意識から、原審争点1では特許請求の範囲における「有効成分」の意義の解釈が問題になりました。
なお、原審では上記以外の争点もありましたが、裁判所は争点1、2のみ判断し、被告ら製剤は本件発明の技術的範囲に属するということはできないとして、原告の請求を棄却しました。
・原審争点1について
裁判所は、「有効成分」という用語の意義を、製剤として組成される基となる「原薬」のことをいうものと解し、被告ら製剤にとって「有効成分」に当たるものは、「原薬」であるナルフラフィン塩酸塩であり、本件化合物であるナルフラフィン(フリー体)ではないとして、被告ら製剤は本件特許の構成要件を充足しないとの判断を示しました(太字・傍線はすべて筆者によります。以下同)。
本件発明の特許請求の範囲は「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」というものであり,本件発明は「止痒剤」という医薬品の製剤を組成する「有効成分」に関する発明であるところ,本件特許権に関する特許公報(甲2)に掲載された本件明細書の記載内容を見ても,この構成要件Aの「有効成分」という用語について特段の定義をした記載は見当たらない。そうすると,本件発明において,この「有効成分」という用語は,医薬品の分野における当業者が理解する通常の意味で用いられているというべきである。
(略)
医薬品の分野において,製剤は,主に単一成分の結晶であるフリー体又は複合成分の結晶である水和物及び塩の形態をとっている原薬を有効成分として,これに,色素,香料,甘味剤,充塡剤,矯味薬,賦形剤などの添加剤を加えて組成されたものをいうと認められる。そうすると,「止痒剤」という製剤を組成する「有効成分」に関する発明である本件明細書の記載に接した当業者としては,通常,この構成要件Aの「有効成分」とは,添加剤を加えて製剤として組成される基となる原薬のことをいうものと理解するといえ,同「有効成分」との文言については,同様の意義を有するものと解するのが相当である。
(略)
当業者は,通常,構成要件Aの「有効成分」とは,添加剤を加えて製剤として組成される基となる原薬のことをいうものと理解するのであって,構成要件Aの「有効成分」との文言は,同様の意義を有するものと解されるところ, 被告ら製剤において,投与前の医薬品に含まれているのがナルフラフィン塩酸塩であると認められる以上, 被告ら製剤において,ナルフラフィン(フリー体)が構成要件Aの「有効成分」に当たるとはいえない。
なお、上述した本件特許の延長登録4件について、特許庁は、本件の原審判決と同様に、「ナルフラフィン塩酸塩」のみを有効成分と解し、「ナルフラフィン(フリー体)」は本件医薬品の有効成分ではないと認定し、無効審決または拒絶審決をしていました。しかし、本件の原審判決の言い渡し直前に、知財高裁は、これらの審決に対する審決取消訴訟において、「有効成分」の意義を狭く解釈した審決は誤りであるとして、当該延長登録4件に対する無効審決および拒絶審決を取り消す判決を下していました。
以下は、本件特許の延長登録の無効審決に対する審決取消訴訟(上記②:知財高判令和2年(行ケ)10063号)の判決文を一部抜粋したものです。
本件発明の実施に本件処分を受けることが必要であったかどうかは,このような特許法の存続期間延長の制度が設けられている趣旨に照らして判断されるべきであり,その場合における本件処分の内容の認定についても,このような観点から実質的に判断されるべきであって,承認書の「有効成分」の記載内容から形式的に判断すべきではない。このように解することは,最高裁平成26年(行ヒ)第356号同27年11月17日第三小法廷判決・民集69巻7号1912頁の趣旨にも沿う
(略)
本件処分の対象となった本件医薬品の有効成分は,本件承認書に記載された「ナルフラフィン塩酸塩」と形式的に決するのではなく,実質的には,本件医薬品の承認審査において,効能,効果を生ぜしめる成分として着目されていたフリー体の「ナルフラフィン」と,本件医薬品に配合されている,その原薬形態の「ナルフラフィン塩酸塩」の双方であると認めるのが相当である。
このように、特許請求の範囲に記載された「有効成分」の用語の意義を巡り、本件侵害訴訟の原審判決と、知財高裁による審決取消判決とで判断が分かれていました。本件侵害訴訟の原審判決は、特許権の技術的範囲の解釈の場面であるため、審決取消判決における延長登録要件の解釈の場面とは異なりますが、特許庁による審決と同様に「有効成分」の用語の意義を狭く解釈した形になります。したがって、本件侵害訴訟の控訴審において知財高裁は、当該「有効成分」の用語の意義についてどのように解釈するのかが注目されていたといえるでしょう。
・原審争点2について
裁判所は、本件発明については、本件化合物の酸付加塩であるナルフラフィン塩酸塩を有効成分とする被告ら製剤が、本件特許出願の手続において特許請求の範囲から意識的に除外されたものに当たるなどの、被告ら製剤と本件発明に記載された構成とが均等なものといえない特段の事情が存するとして、被告ら製剤は、本件発明に記載された構成と均等なものとして、本件発明の技術的範囲に属するということはできないと判断しました。
出願人たる原告は,本件特許出願時に,本件化合物の薬理学的に許容される酸付加塩を有効成分とする構成を容易に想到することができたにもかかわらず,これを特許請求の範囲に記載しなかったものであるといえ,しかも,客観的,外形的にみて,上記構成が本件発明に記載された構成(本件化合物を有効成分とする構成)を代替すると認識しながらあえて特許請求の範囲に記載しなかった旨を表示していたといえるものというべきである。
そうすると,本件発明については,本件化合物の酸付加塩であるナルフラフィン塩酸塩を有効成分とする被告ら製剤が,本件特許出願の手続において特許請求の範囲から意識的に除外されたものに当たるなどの,被告ら製剤と本件発明に記載された構成(本件化合物を有効成分とする構成)とが均等なものといえない特段の事情が存するというべきである。
本判決の判断
争点概要
本件の争点は以下のとおり多岐にわたります。本記事では、侵害論の争点のうち、争点1、4、6のみ取り上げています。
(侵害論の争点)
| 争点1: | 被告製剤は本件発明の技術的範囲に属するか |
| 争点2: | 被告製剤は本件発明に記載された構成と均等なものか |
| 争点3: | (欠番) |
| 争点4: | 本件延長登録等により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶか |
| 争点5: | 本件延長登録等は、本件発明の実施のために、本件処分等(医薬品「レミッチOD錠2.5㎍」に係る承認処分)を受けることが必要であったとは認められない場合であり無効にされるべきことから、原告による本件特許権の行使は権利濫用か |
| 争点6: | 本件延長登録等は、延長期間が本件発明の実施をすることができなかった期間を超えており無効にされるべきものか |
| 争点7: | 先使用権の存否 |
(損害論の争点)
⑴ 特許法102条1項に基づく損害に関する争点
| 争点8: | 独占的通常実施権者の損害賠償請求権の成否 |
| 争点9: | 単位数量当たりの利益の額 |
| 争点10: | 販売することができないとする事情の有無及び当該事情に相当する数量等 |
⑵ 特許法102条3項等に基づく損害に関する争点
| 争点11: | 適正な実施料 |
⑶ 損害一般に関する争点
| 争点12: | 消費税相当額を加算して損害を算定することの可否 |
| 争点13: | 原告の損害額 |
裁判所の判断の概要
知財高裁は、侵害論に関して、被告製剤は、原告の本件発明の技術的範囲に属するものであり(争点1)、本件延長登録等により存続期間が延長された本件特許権の効力は被告製剤の製造販売等の行為に及び(争点4)、本件延長登録等が無効にされるべきものとはいえず(争点5、争点6)、先使用権も認められない(争点7)から、被告製剤は延長登録された原告の本件特許権を侵害するものと認めるのが相当と判断すると述べました。
また、損害論に関して、本件特許権の独占的通常実施権者の損害賠償請求権が成立し(争点8)、原告は、これを併せて被告らに対して損害賠償請求をすることができるから、被告らが販売した被告製剤については特許法102条1項に係る単位数量当たりの利益の額に基づく損害を請求することができ(争点9)、同項1号の「販売することができないとする事情」を認めることはできず(争点10)、未譲渡の被告製剤については同条3項に係る適正な実施料(9%)に基づく損害が認められ(争点11)、消費税相当額の加算は、同条1項に係る損害については認められないが、同条3項に係る適正な実施料については認められる(争点12)から、原告の損害額(争点13)は、別紙「裁判所認容額目録」記載のとおり(被告Aによる142億9093万9291円(及び遅延損害金)、被告Bによる74億7287万8838円(及び遅延損害金))と判断すると述べました。
争点1(本件発明の技術的範囲と被告製剤について)の判断
知財高裁は、延長された本件特許権の効力が被告製剤に及ぶかを判断するにあたり、1段階目のステップとして、被告製剤が特許発明の技術的範囲に属するかについて判断を示しました。
・本件発明の技術的範囲
知財高裁は、まず、本件発明の「有効成分」の用語の意義について、一般的には、体内(血中)で溶出し薬理作用を発揮する化学物質の意味であると述べました。
・・・「有効成分」の用語は、・・・本件特許出願の日の前後を通じて、体内(血中)で溶出し薬理作用を発揮する化学物質の意味で用いられる場合が一般的に見られていたものであり、本件明細書において、これと異なる解釈をとるべき理由は見当たらない。
つづいて知財高裁は、本件発明の目的が「止痒作用が極めて速くて強いオピオイドκ受容体作動薬及びこれを含んでなる止痒剤を提供すること」にあることを確認しました。その上で、製剤の技術分野において薬物の溶解性や安定性を向上させるために酸付加塩の形態をとることは、本件特許の出願当時の技術常識であったことを踏まえれば、当業者は、本件発明の目的である止痒作用を発揮する化学物質は「κ受容体作動性化合物」であって、酸付加塩の形態は、薬としての溶解性や安定性を向上させるための形態にすぎないことを容易に理解できたとし、請求項に本件化合物(フリー体)を有効成分とする止痒剤」とだけ記載されていることを理由に、ナルフラフィンの酸付加塩が本件発明における有効成分に当たらない、とは解釈できない旨を述べました。
もともと、本件発明の目的は、止痒作用が極めて速くて強いオピオイドκ受容体作動薬及びこれを含んでなる止痒剤を提供することにある。・・・製剤の技術分野において、本件特許の出願当時、薬物の溶解性や安定性を向上させるために酸付加塩の形態をとることは、技術常識であったと認められ、本件明細書の記載によっても、酸付加塩の形態について、それ以外の技術的意義があることを認めるに足りない。したがって、本件明細書をみた当業者は、本件発明の目的である止痒作用を発揮する化学物質は「κ受容体作動性化合物」であって、「薬理学的に許容される酸付加塩」の形態は、物質の止痒作用自体を変化させるためのものではなく、薬としての溶解性や安定性を向上させるための形態にすぎないことは容易に理解することができたはずである。そうすると、製剤開発の分野や薬事承認に際して、添加剤と区別するため、化合物とその薬理学的に許容される酸付加塩を含めて「有効成分」と呼ぶ場合があることを踏まえたとしても、当業者において、請求項1に「オピオイドκ受容体作動性化合物を有効成分とする止痒剤」とだけ記載されていることを理由に、その趣旨が、「薬理学的に許容される酸付加塩」は、本件発明1でいう有効成分には当たらず、特許の技術的範囲外であると解釈するとは考えられない。
さらに、出願経過参酌の原則(禁反言)及び信義則から本件発明から酸付加塩が意識的に除外された、とは認められない旨を述べました。
本件特許の出願経過を参酌しても、原告は、本件補正により、補正前の請求項3の一般式(Ⅰ)を含む発明を補正後の請求項1に補正し、その際「またはその薬理学的に許容される酸付加塩」の文言を欠落させたことが認められるが、拒絶理由通知・・・においては、補正前の請求項3は拒絶の対象にされておらず、原告の意見書・・・においても、一般式(Ⅰ)の化合物に対する言及を含め、補正後の請求項1において「またはその薬理学的に許容される酸付加塩」の文言を欠落させたことについての説明はされていない。そうすると、本件特許の出願経過において、原告が、本件補正の際に、補正後の請求項1から「酸付加塩」の文言を意識的に除外したと認めることはできないというべきである。
以上を踏まえ、知財高裁は、本件発明の技術的範囲に関し、本件発明は酸付加塩の形態をとるか否かにかかわらず、本件化合物が、生体内において溶出して吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解釈するべきである旨を述べました。
以上のとおり、特許請求の範囲及び本件明細書の記載、本件特許の出願経過及び本件特許出願日当時の技術常識によれば、本件発明1は、酸付加塩の形態をとるか否かにかかわらず、一般式(Ⅰ)で表される化合物が、生体内において溶出して吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいうものと解するのが相当である。
・被告製剤の本件発明の構成要件充足性
知財高裁は、上述した「有効成分」の意義および本件発明の技術的範囲の解釈を踏まえれば、生体内において溶出して吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、その酸付加塩であるナルフラフィン塩酸塩の形態で配合された被告製剤は、本件発明の構成要件を充足すると認定しました。
被告製剤は、生体内において溶出して吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、その酸付加塩であるナルフラフィン塩酸塩の形態で配合された医薬品であると認められるから、被告製剤は、本件発明1の「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」の構成要件を充足するものと認められる。
以上のとおり、知財高裁は、被告製剤は本件発明の「一般式(Ⅰ)で表されるオピオイドκ受容体作動性化合物を有効成分とする止痒剤」の構成要件を充足し、その技術的範囲に属するものとの判断を示しました。
争点4(存続期間が延長された本件特許権の効力について)の判断
知財高裁は、延長された本件特許権の効力が被告製剤に及ぶかの判断の2段階目のステップとして、特許法第68条の2に基づき、延長された特許権の効力が被告製剤に及ぶかについて判断を示しました。
・延長後の特許権の効力が及ぶ範囲
知財高裁は、争点1で判断したとおり、被告製剤は本件発明の技術範囲に属し、その製造販売等は本件発明の実施に該当することを述べた上で(1段階目のステップ)、問題は、当該実施が対象物についての実施ということができるかどうかにあることを確認しました(2段階目のステップ)。そして、延長後の特許権の効力が及ぶ範囲を検討するにあたり、薬機法や特許法第68条の2の趣旨に基づいて解釈すべきという原則を示しました。具体的には、薬機法に基づく処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」についての実施のみに限定したときは、少しでも成分等が異なれば特許権の効力が及ばなくなるため、特許法第68条の2の趣旨にそぐわず、一方で、薬機法に基づく処分の対象となった「物」とはおよそ異なる「物」についての実施にも特許権を及ぼすことは、同条の文理に明らかに反すると述べました。
特許法68条の2によれば、本件延長登録等により延長された場合の本件特許権の効力は、本件延長登録等の理由となった本件処分等の対象となった物(その処分においてその物の使用される特定の用途が定められている場合にあっては、当該用途に使用されるその物)( 以下「対象物」という。)についての本件発明の実施以外の行為には及ばない。前記のとおり、被告製剤は本件発明1の技術範囲に属し、その製造販売等は本件発明1の実施に該当するから、問題は、当該実施が対象物についての実施ということができるかどうかである。しかるところ、 薬機法上、その処分の対象は原告製剤であるが、薬機法に基づく処分の対象は、医薬品の品質、有効性及び安全性の確保等といった薬機法の目的により定まるのに対し、特許法68条の2の対象物の範囲は、延長登録の制度趣旨及び特許権者と第三者との衡平を考慮し、特許法の観点から合理的に解釈すべきものである。すなわち、存続期間が延長された特許権の効力を、薬機法に基づく処分で定められた「成分、分量、用法、用量、効能及び効果」によって特定された「物」についての実施のみに限定したときは、少しでも成分等が異なれば特許権の効力が及ばなくなるから、存続期間延長により特許権者を保護しようとした法の趣旨にそぐわない結果となる。他方、薬機法に基づく処分の対象となった「物」とはおよそ異なる「物」についての実施にも特許権を及ぼすことは、同条の文理に明らかに反することになる。
その上で、薬機法に基づく本件処分の対象となった原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から「実質同一」であると認められる物については、延長後の特許権の効力が及ぶ旨を述べました。
薬機法に基づく処分で特定された「物」から出発し、特許発明の技術的意義及び政令処分の内容に照らし、これと医薬品として「実質同一」であると認められる範囲の物についての実施に限り、延長後の特許権の効力が及ぶと解するのが相当である。そうすると、本件における対象物には原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から実質同一であると認められるものも含まれるというべきである。
そして、上記実質同一の意義について、上述した「オキサリプラチン事件」(知財高判大合議平成29年1月20日平成28年(ネ)第10046号)を引用し、原告製剤と被告製剤とが、技術的特徴、作用効果、剤形において同一であり、両製剤の差異が僅かな差異又は全体的にみて形式的な差異にすぎない場合は、実質同一である旨を述べました。
本件発明1が本件特許出願当時既に公知の物質であった「一 般式(Ⅰ)で表されるκ受容体作動性化合物」を止痒剤としての作用効果を 有する有効成分として用いた用途発明である点に発明としての技術的特徴があること・・・を踏まえると、 原告製剤と被告製剤がナルフラフィンを有効成分とする止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形を同一にする場合において、被告製剤が、有効成分ではない「成分」に関して、政令処分申請時における周知・慣用技術に基づき、一部において異なる成分を付加、転換等しているにすぎないと認められるときや、有効成分以外の被告製剤との「成分」等の差異が医薬品としての「効能及び効果」に影響を与えず、当該差異が僅かな差異又は全体的にみて形式的な差異にすぎないと認められるときは、医薬品としては、本件処分の対象となった原告製剤と実質同一なものに該当するというべきである(知財高裁平成28年(ネ)第10046号平成29年1月20日特別部判決参照)
以上を踏まえた上で、知財高裁は、本件発明の技術的特徴は医薬用途発明にあり、添加剤についてはなんら特定されていないところ、原告製剤と被告製剤は「有効成分、分量」及び「用法、用量、効能、効果」は同じであり、両製剤は有効成分を除く添加剤の限度で成分を異にするものにすぎず、両製剤は実質同一であるとしました。
本件発明1は、「一般式(Ⅰ)で表される化合物のκ受容体作動性」という未知の属性に基づき新たな止痒剤としての医薬用途を提供する医薬用途発明である点に発明としての技術的特徴があるものであって、止痒剤に含有される添加剤については何ら特定していない。本件明細書においても、κ受容体作動薬を経口又は非経口的に投与するに際して担体や賦形剤などと混合した医薬組成物とすることや、経口剤でのκ受容体作動薬の含量の記載がある程度である。
他方、原告製剤と被告製剤は、いずれも、一般式(Ⅰ)で表されるκ受容体作動性化合物であるナルフラフィンを有効成分とする止痒剤であり、レミッチカプセル2.5㎍との生物学的同等性が確認された医薬品である。両製剤は、いずれも、経口投与剤として、レミッチカプセル2.5㎍と有効性及び安全性において違いの生じないOD錠となるように開発され、また、被告製剤の用途は原告製剤の用途の開発に合わせたものと解されるものであり、その「有効成分、分量」及び「用法、用量、効能、効果」は同じであり・・・、両製剤は有効成分を除く添加剤の限度で成分を異にするものにすぎない。しかるところ、一般に、添加剤とは、前記技術常識のとおり、その製剤の投与量において薬理作用を示さず、無害であり、また、有効成分の治療効果を妨げないものとして加えられるものである。原告製剤に係る本件明細書等の前記記載や、被告製剤の開発経過に照らしても、両製剤に使用されている各添加剤がこれと異なる技術的意義を持つものとは認められない。
原告製剤と被告製剤は、ナルフラフィンを有効成分とする前記用途の止痒剤という点でその技術的特徴及び作用効果が同一であり、かつ、医薬品としての具体的な剤形も同一である。原告製剤と被告製剤のこれらの共通点や前記の添加剤の意義に照らすと、原告製剤と被告製剤の添加剤における差異は僅かな差異又は全体的にみて形式的な差異に当たり、被告製剤は、医薬品として本件処分等の対象となった原告製剤と実質同一なものに該当するというべきである。
知財高裁は、以上のように述べて、本件延長登録等により存続期間が延長された本件特許権の効力は被告製剤の製造販売等に及ぶものと認めるのが相当であるとの判断を示しました。
争点6(延長登録の延長期間について)の判断
知財高裁は、まず、延長登録を求める期間は、政令で定める処分を受けるために特許発明を実施することができなかった期間を超えないことを要し、当該期間は、「承認を受けるのに必要な試験を開始した日又は特許権の設定登録の日のうちのいずれか遅い方の日から、承認が申請者に到達することにより処分の効力が発生した日の前日までの期間」であることを確認しました。
特許権の存続期間の延長が認められるためには、延長登録出願において延長登録を求める期間(延長登録により延長された期間)が、前記政令で定める処分を受けるために特許発明を実施することができなかった期間を超えないことを要するものと解される。
(略)
そして、「特許発明の実施をすることができなかった期間」は、承認を受けるのに必要な試験を開始した日又は特許権の設定登録の日のうちのいずれか遅い方の日から、承認が申請者に到達することにより処分の効力が発生した日の前日までの期間であると解される(最高裁平成10年(行ヒ)第43号平成11年10月22日第二小法廷判決・民集53巻7号1270頁)。
また、本件処分に係る剤形をOD錠とする製剤の承認申請の審査において、剤形を軟カプセル剤とする製剤に対する先行処分においてなされた臨床試験結果が用いられ、その結果、本件処分に係る剤形をOD錠とする製剤が承認されたことを認定しました。
本件処分に係る医薬品(レミッチOD錠2.5㎍)の承認申請においては、「剤形追加に係る医薬品」の承認申請時に提出を求められる「生物学的同等性」資料だけでなく、既承認医薬品につき実施されたこれらの試験に関する記載のある添付文書(案)や、既承認医薬品(レミッチカプセル2.5㎍等)に関する審査報告書等の資料が提出されたことで、原告の行った前記ウの各臨床試験が、本件処分に係る医薬品の有効性及び安全性を検証及び確認するために必要な資料として各審査時点で評価試料として審査に用いられ、その結果、前記医薬品(原告製剤)について「次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)血液透析患者、慢性肝疾患患者」との用途で承認されたことが推認され、これを覆すに足りる証拠はない。
以上を前提として、知財高裁は、軟カプセル剤に関する臨床試験についても、本件処分に係るOD錠の承認を受けるのに必要な試験であるとの判断を示した上で、「特許発明の実施をすることができなかった期間」の起算点である「承認を受けるのに必要な試験を開始した日」を、当該軟カプセル剤に関する臨床試験を開始した日(具体的には、当該試験の治験計画変更届出日)であると認定し、当該期間は、本件延長登録によって延長された期間(4年11月26日)を超えるものではない旨の判断を示しました。
このように、知財高裁は、剤形を「OD錠」とする医薬品の承認を受けるにあたって、剤形の異なる「軟カプセル剤」に対して行われた臨床試験の期間についても、延長期間を算定するための試験期間に含める判断をしたことになります。
なお被告らは、本件特許においては剤形を「軟カプセル剤」とする延長登録が別途認められていることを理由として、本件のOD錠の承認に伴う本件延長登録等に軟カプセル剤の臨床試験期間を再度算定することは、実質的に二重に臨床試験期間を回復することになり制度趣旨に反する、と主張していました。当該主張に対して、知財高裁は、まず、「特許発明の実施をすることができなかった期間」は、薬機法に基づく当該医薬品の承認手続の内容、承認による禁止解除の範囲についての解釈を踏まえ、特許法の観点から個別に判断される旨を述べました。その上で、軟カプセル剤に関する臨床試験も本件のOD錠の承認を受けるのに必要な試験であり、現に軟カプセル剤に関する試験結果等がOD錠に対する承認申請における審査対象とされたことに加え、軟カプセル剤の承認による禁止解除の範囲は剤形を軟カプセル剤とする場合に限定され、直ちにはOD錠には及ばないため、軟カプセル剤の承認を受けただけで、本件処分等を受けることなくOD錠の剤形で本件特許を実施することができるわけではないとして、被告らの主張を退けました。
被告らは、OD錠の承認に伴う本件延長登録等に軟カプセル剤の臨床試験期間を再度算定することは、実質的に二重に臨床試験期間を回復することになり制度趣旨に反するなどと主張する。しかしながら、医薬品における「前記政令で定める処分を受けるために特許発明を実施することができなかった期間」は、薬機法に基づく当該医薬品の承認手続の内容、承認による禁止解除の範囲についての解釈を踏まえ、特許法の観点から個別に判断されるものである。本件においては、OD錠である原告製剤を製造販売等するためには、本件処分等により禁止解除を得る必要があったところ、・・・各試験が「承認を受けるのに必要な試験」であったと認められる・・・。また、現に軟カプセル剤に関する試験結果や効能・効果の内容等については、OD錠に関する本件処分等の承認申請手続においても資料が提出されて審査対象とされたことが認められる。加えて、軟カプセル剤の承認による禁止解除の範囲は当該軟カプセル剤の剤形に限定され、直ちにはOD錠には及ばないのであり、原告において、同じ有効成分・分量、用法・用量及び効能・効果であっても、軟カプセル剤の承認を受けただけで、本件処分等を受けることなくOD錠の剤形で本件特許を実施することができるわけではない。これらの点を考慮すると、被告らの主張を採用することはできない。
まとめ
以上のとおり、争点1、4、6に関し、原審と控訴審(本件)の判決の内容をまとめると下記のとおりとなります。
| 原審 | 控訴審(本件) | ||
| 裁判所 | 東京地裁 | 知財高裁 | |
| 本件発明の技術的範囲 (争点1) |
文言侵害 | 文言侵害不成立 ・「有効成分」は、添加剤を加えて製剤として組成される基となる原薬をいう。 ・投与前の被告ら製剤に含まれているのはナルフラフィン塩酸塩である。 ・よって被告ら製剤においてナルフラフィン(フリー体)が構成要件の「有効成分」に当たるとはいえない。 |
文言侵害成立 ・本件発明はオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいう。 ・被告製剤は、生体内において溶出して吸収され、上記属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、その酸付加塩であるナルフラフィン塩酸塩の形態で配合された医薬品である。 ・よって被告製剤は本件発明の構成要件を充足する。 |
| 均等侵害 | 均等侵害不成立 ナルフラフィン塩酸塩を特許請求の範囲に記載しなかったのは、意識的除外にあたる。 |
判断せず (但し、文言侵害において、ナルフラフィン塩酸塩の意識的除外にあたらない旨の判断あり) |
|
| 延長された特許権の効力(争点4) | 判断せず | 延長された特許権の効力が及ぶ 原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から「実質同質」であると認められる物に対し延長後の特許権の効力が及ぶため、添加剤の限度で成分を異にする被告製剤の実施行為にも及ぶ。 |
|
| 延長登録の延長期間 (争点6) |
判断せず | 延長期間は特許発明を実施することができなかった期間を超えるものではない 先行処分のための臨床試験結果が、有効成分、分量、用法・用量及び効能・効果が同一で、剤形が異なる製剤の承認審査に用いられた場合、当該臨床試験の期間も、後行処分のために必要な期間として算入される。 |
|
コメント
本件発明の技術的範囲と被告製剤について
特許請求の範囲に記載された「有効成分」の意義に関しては、本件侵害訴訟の原審判決と、知財高裁による審決取消判決とで判断が分かれていました。本件の原審において東京地裁は、特許権の技術的範囲としての「有効成分」の意義を特許庁による審決と同様に狭く解釈したため、本件の控訴審において、知財高裁が当該「有効成分」の意義をどのように解釈するのかが注目されていたといえます。
知財高裁は、以下のような流れで、被告製剤は本件特許の技術的範囲に属するという判断を導きました。
- 「有効成分」とは「体内(血中)で溶出し薬理作用を発揮する化学物質」をいう。
- 本件発明の目的や製剤分野における技術常識等を踏まえると、酸付加塩の形態は薬物の溶解性や安定性を向上させるための形態にすぎず、ナルフラフィンの酸付加塩が本件発明における有効成分に当たらないとは解釈できないし、本件発明から意識的に除外されたともいえない。
- 本件発明は、本件化合物が生体内において溶出して吸収され、そのオピオイドκ受容体作動性という属性に基づき「有効成分」としての薬理作用を発揮するような止痒剤をいう。
- 被告製剤は、生体内において溶出して吸収され、オピオイドκ受容体作動性という属性に基づき止痒作用を及ぼし薬効を奏するナルフラフィンが、酸付加塩の形態で配合されたものであるため、本件発明の止痒剤にあたる。
このように知財高裁は、本件発明の目的(止痒作用が極めて速くて強いオピオイドκ受容体作動薬及びこれを含んでなる止痒剤を提供すること)や、酸付加塩に関する技術常識を踏まえ、有効成分が奏する効果に着目して、本件発明の技術的範囲を解釈し、被告製剤が本件発明の構成要件を充足すると認定しました。本判決が、有効成分を構成要件とする医薬用途発明の技術的範囲の解釈につき一定の指針を示した点は、実務上重要であると思われます。
存続期間が延長された本件特許権の効力について
延長された特許権の効力について、知財高裁は、まず、薬機法や特許法第68条の2の趣旨に基づいて解釈すべきという原則を示しました。その上で、薬機法に基づく本件処分の対象となった原告製剤と医薬品としての「成分、分量、用法、用量、効能及び効果」が特許法の観点から「実質同一」であると認められる物については、延長後の特許権の効力が及ぶ旨の判断を示しました。「実質同一」の意義の解釈については、「オキサリプラチン事件」(知財高判大合議平成29年1月20日平成28年(ネ)第10046号)の判断を踏襲する形となりました。そして、本件発明は、本件化合物のκ受容体作動性という未知の属性に基づき、新たな止痒剤としての医薬用途を提供する医薬用途発明である点に、発明としての技術的特徴がある点を踏まえ、原告製剤と被告製剤とが、技術的特徴ではない添加剤の限度で異なるにすぎず、両者は実質同一であるとして、延長された本件特許権の効力が被告製品に及ぶとしました。
このように本判決は、延長された特許権の効力を検討するにあたり、薬機法や特許法第68条の2の趣旨に基づいて解釈すべきという原則を示した上で、「オキサリプラチン事件」で示された規範を踏まえて、「医薬用途特許」につき延長された特許権の効力が及ぶ範囲を示しています。延長された医薬用途発明に係る特許権の効力について解釈を示した点に、本判決の特徴があるといえるでしょう。
延長登録の延長期間について
延長登録の延長期間に関し、知財高裁は、本件においてOD錠の承認がなされたのは、軟カプセル剤に対する臨床試験の結果も加味された結果であることから、軟カプセル剤に対する臨床試験の期間も、本件の延長期間に含めるべきとしました。すなわち、先行処分のための臨床試験結果が、有効成分・分量、用法・用量及び効能・効果が同一で、剤形が異なる製剤の承認審査に用いられた場合は、当該臨床試験の期間も、後行処分のために必要な期間として算入されるべきとの判断を示したことになります。また、二重に臨床試験期間を回復することになるという被告の主張に対して、知財高裁は、「特許発明の実施をすることができなかった期間」は、薬機法と特許法の観点から個別に判断されるとした上で、軟カプセル剤の承認による禁止解除の範囲は直ちにはOD錠には及ばないため、軟カプセル剤の承認を受けただけで、OD錠の剤形で本件特許を実施できるわけではないとして、被告の主張を退けました。
このように、知財高裁は、先行処分のための臨床試験の期間が、先行処分とは剤形が異なる後行処分に基づく延長期間に算入できる旨の判断を示しており、先発医薬品メーカーにとって有利な判断といえるでしょう。
以上のとおり本判決は、特許発明の技術的範囲における「有効成分」の意義、延長登録された医薬用途発明に係る特許権の効力が及ぶ範囲、及び延長登録の延長期間等に関して一定の指針を示したものであり、実務上重要な判決といえるでしょう。
本記事に関するお問い合わせはこちらから。
(文責・竹下)
- 投稿タグ
- ナルフラフィン, レミッチ, 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律, 存続期間が延長された特許権の効力, 延長登録, 止痒剤, 特許法, 知的財産高等裁判所, 薬機法












